 大环内酯和喹诺酮杂合物及其制备方法.pdf
大环内酯和喹诺酮杂合物及其制备方法.pdf


《大环内酯和喹诺酮杂合物及其制备方法.pdf》由会员分享,可在线阅读,更多相关《大环内酯和喹诺酮杂合物及其制备方法.pdf(37页完成版)》请在专利查询网上搜索。
1、(19)中华人民共和国国家知识产权局 (12)发明专利申请 (10)申请公布号 (43)申请公布日 (21)申请号 201910147739.8 (22)申请日 2019.02.27 (71)申请人 北京理工大学 地址 100081 北京市海淀区中关村南大街5 号 (72)发明人 梁建华马聪璇 (74)专利代理机构 北京润泽恒知识产权代理有 限公司 11319 代理人 莎日娜 (51)Int.Cl. C07H 17/08(2006.01) C07H 1/00(2006.01) A61P 31/04(2006.01) A61P 11/00(2006.01) A61K 31/7048(2006.0。
2、1) (54)发明名称 一种大环内酯和喹诺酮杂合物及其制备方 法 (57)摘要 本发明提供一种大环内酯和喹诺酮杂合物, 其特征在于, 所述大环内酯和喹诺酮杂合物包括 具有通式I和通式的化合物, 或者, 所述大环内 酯和喹诺酮杂合物包括所述通式I和通式的化 合物与无机酸或有机酸形成的药学可接受的盐, 所述大环内酯和喹诺酮杂合物既能够较好的适 应工业化生产, 并且针对临床上常见的红霉素耐 药的肺炎链球菌、 金黄色葡萄球菌、 化脓链球菌、 卡他莫拉和嗜血流感菌等致病菌具有良好的抗 敏感菌和抗耐药菌活性, 能有效治疗临床细菌性 肺炎或者其他微生物(如支原体、 军团菌属等)引 起的肺炎、 以及其他组织感。
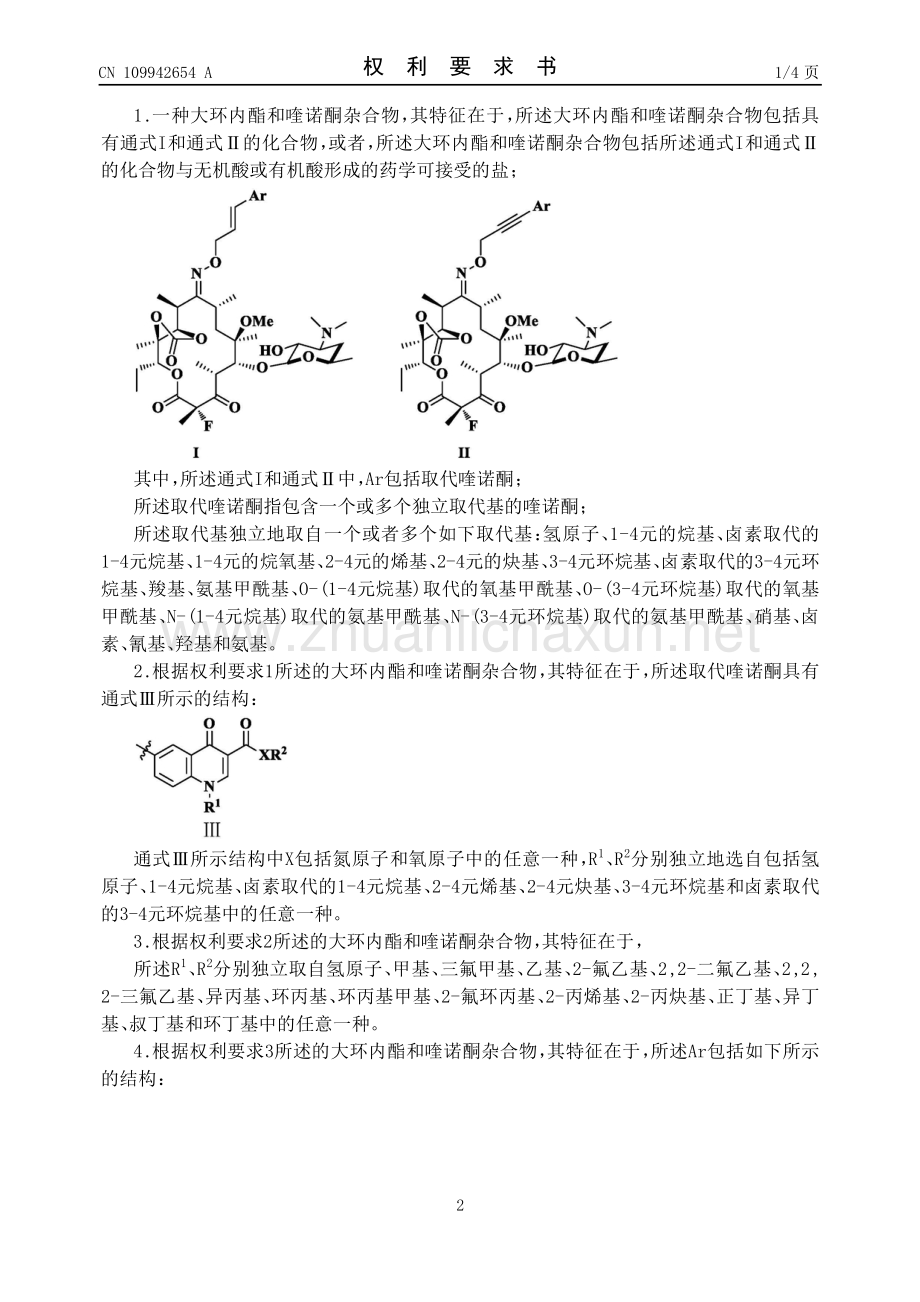
3、染; 权利要求书4页 说明书31页 附图1页 CN 109942654 A 2019.06.28 CN 109942654 A 1.一种大环内酯和喹诺酮杂合物, 其特征在于, 所述大环内酯和喹诺酮杂合物包括具 有通式I和通式的化合物, 或者, 所述大环内酯和喹诺酮杂合物包括所述通式I和通式 的化合物与无机酸或有机酸形成的药学可接受的盐; 其中, 所述通式I和通式中, Ar包括取代喹诺酮; 所述取代喹诺酮指包含一个或多个独立取代基的喹诺酮; 所述取代基独立地取自一个或者多个如下取代基: 氢原子、 1-4元的烷基、 卤素取代的 1-4元烷基、 1-4元的烷氧基、 2-4元的烯基、 2-4元的炔基、。
4、 3-4元环烷基、 卤素取代的3-4元环 烷基、 羧基、 氨基甲酰基、 O-(1-4元烷基)取代的氧基甲酰基、 O-(3-4元环烷基)取代的氧基 甲酰基、 N-(1-4元烷基)取代的氨基甲酰基、 N-(3-4元环烷基)取代的氨基甲酰基、 硝基、 卤 素、 氰基、 羟基和氨基。 2.根据权利要求1所述的大环内酯和喹诺酮杂合物, 其特征在于, 所述取代喹诺酮具有 通式所示的结构: 通式所示结构中X包括氮原子和氧原子中的任意一种, R1、 R2分别独立地选自包括氢 原子、 1-4元烷基、 卤素取代的1-4元烷基、 2-4元烯基、 2-4元炔基、 3-4元环烷基和卤素取代 的3-4元环烷基中的任意一种。
5、。 3.根据权利要求2所述的大环内酯和喹诺酮杂合物, 其特征在于, 所述R1、 R2分别独立取自氢原子、 甲基、 三氟甲基、 乙基、 2-氟乙基、 2,2-二氟乙基、 2,2, 2-三氟乙基、 异丙基、 环丙基、 环丙基甲基、 2-氟环丙基、 2-丙烯基、 2-丙炔基、 正丁基、 异丁 基、 叔丁基和环丁基中的任意一种。 4.根据权利要求3所述的大环内酯和喹诺酮杂合物, 其特征在于, 所述Ar包括如下所示 的结构: 权利要求书 1/4 页 2 CN 109942654 A 2 5.如权利要求1所述的大环内酯和喹诺酮杂合物, 其特征在于: 所述无机酸包括盐酸、 硫酸、 氢溴酸、 氢碘酸和磷酸中的。
6、任意一种; 所述有机酸包括醋酸、 丙二酸、 甲磺酸、 琥珀酸、 对甲苯磺酸、 柠檬酸、 富马酸和苹果酸 中的任意一种。 6.一种大环内酯和喹诺酮杂合物的制备方法, 其特征在于, 所述方法包括: 第二化合物的制备: 将第一化合物溶解在二氯甲烷中, 滴加乙酸酐反应, 反应过程中使 用薄层色谱监控, 反应完全结束后, 使用饱和碳酸氢钠NaHCO3溶液洗5次, 再用饱和氯化钠 NaCl溶液洗1次, 旋干, 起泡后在真空烘箱中干燥, 得到第二化合物; 第三化合物的制备: 将所述第二化合物溶于四氢呋喃, 再加入二甲亚砜, 在氩气保护下 添加叔丁醇钾, 在室温下反应, 薄层色谱监控所述第二化合物9位乙酰基全。
7、部脱去后补加叔 丁醇钾, 在氩气保护下滴加80炔丙基溴, 反应30-45分钟, 薄层色谱监控反应进程, 反应结 束后, 加入乙酸乙酯与蒸馏水, 使用乙酸乙酯萃取水相三次, 合并有机相, 使用饱和NaCl溶 液洗涤有机相, 旋干, 起泡后在真空烘箱中干燥, 得到第一中间产物; 将所述第一中间产物溶于二氯甲烷, 在氩气保护、 -10的环境下, 滴加吡啶, 再滴加三 光气的二氯甲烷溶液, 保持温度不变反应, 再转移至常温下反应至反应结束, 冰浴下滴加饱 和NaCl溶液, 常温搅拌, 用蒸馏水、 饱和NaHCO3, 饱和NaCl溶液依次洗涤有机相, 分液获得有 机相, 旋干, 柱层析获得第三化合物; 。
8、第四化合物的制备: 将N-氯代丁二酰亚胺溶于二氯甲烷, 在-15下搅拌, 逐滴加入二 甲硫醚, 产生白色絮状沉淀, 将所述第三化合物溶于二氯甲烷缓慢滴加到N-氯代丁二酰亚 胺的二氯甲烷溶液中, 在-10下, 搅拌反应至薄层色谱监控所述第四化合物转化率在95 以上, 将温度调至-5, 滴加三乙胺, 反应完全结束后, 依次用蒸馏水、 饱和NaHCO3溶液、 饱 和NaCl溶液洗涤有机相, 分液获得有机相, 旋干, 获得第四化合物; 第五化合物的制备: 在0下将所述第四化合物溶于N,N-二甲基甲酰胺, 待温度稳定 后, 在氩气保护下加入60的氢化钠NaH反应, 再将反应转移至-5冰盐浴, 加入N-氟。
9、代双 苯磺酰胺搅拌, 薄层色谱监控反应完全结束后, 依次用氢氧化钠NaOH溶液、 饱和NaHCO3, 饱 权利要求书 2/4 页 3 CN 109942654 A 3 和NaCl溶液洗涤有机相, 分液获得有机相, 旋干, 柱层析后获得第五化合物; 第六化合物的制备: 将碘化亚铜、 三乙胺、 取代喹诺酮的卤代物溶于乙腈, 置于压力瓶 中常温搅拌, 加入所述第五化合物、 双(三苯基磷)二氯化钯用氩气置换8次, 密封, 于60搅 拌反应至反应完全, 反应完成后加入乙酸乙酯, 再用蒸馏水水洗3次, 饱和氯化钠溶液洗1 次, 分液获得有机相, 旋干, 获得第二中间产物, 将所述第二中间产物溶于甲醇, 在。
10、65下回 流, 薄层色谱监控反应完全结束后旋干反应液获得粗品, 柱层析后获得如通式所示的第 六化合物。 7.根据权利要求6所述的制备方法, 其特征在于, 所述第二化合物的制备的步骤之后, 所述方法还包括: 第七化合物的制备: 将所述第二化合物溶于四氢呋喃, 再加入二甲亚砜, 在氩气保护下 加入叔丁醇钾, 室温下反应至薄层色谱监控所述第二化合物的9位乙酰基全部脱去, 补加叔 丁醇钾, 氩气保护下加入烯丙基溴, 反应30-40分钟, 薄层色谱监控反应完全后, 加入二氯甲 烷与蒸馏水, 分液后用二氯甲烷三次萃取水相, 合并有机相, 用饱和NaCl溶液洗涤有机相, 旋干起泡, 烘干, 得到所述第七化合。
11、物; 第八化合物的制备: 将所述第七化合物溶于二氯甲烷, 在氩气保护、 -10下滴加吡啶, 再滴加三光气的二氯甲烷溶液, 保持-10反应4小时, 再移至常温反应18小时后进行后处 理, 后处理时在冰浴下滴加饱和NaCl溶液, 常温搅拌, 后用蒸馏水、 饱和NaHCO3, 饱和NaCl溶 液洗涤有机相, 分液, 旋干, 柱层析获得所述第八化合物; 第九化合物的制备: 将N-氯代丁二酰亚胺溶于二氯甲烷, 在-15下搅拌, 逐滴加入二 甲硫醚, 产生白色絮状沉淀, 将所述第八化合物的二氯甲烷溶液缓慢滴加到N-氯代丁二酰 亚胺的二氯甲烷溶液中, 在-10下, 搅拌反应至薄层色谱监控所述第八化合物转化率。
12、在 95以上, 将温度调至-5, 滴加三乙胺, 反应完全结束后, 依次用蒸馏水、 饱和NaHCO3溶 液、 饱和NaCl溶液洗涤有机相, 分液获得有机相, 旋干, 获得所述第九化合物; 第十化合物的制备: 在0下将所述第九化合物溶于N,N-二甲基甲酰胺, 待温度稳定 后, 在氩气保护下加入60NaH反应, 后将反应转移至-5冰盐浴中, 加入N-氟代双苯磺酰 胺保持温度, 搅拌, 薄层色谱监控反应完全后, 依次加入NaOH溶液, 饱和NaHCO3, 饱和NaCl溶 液洗涤有机相, 分液, 旋干, 柱层析获得所述第十化合物; 第十一化合物的制备: 将所述第十化合物、 醋酸钯、 三(邻甲基苯基)磷、。
13、 取代喹诺酮的 卤代物、 三乙胺溶于乙腈, 置于压力瓶中, 氩气置换8次, 密封后在60下反应, 后升温至90 搅拌, 反应完全后加入乙酸乙酯, 水洗3次, 饱和氯化钠溶液洗1次, 分液后旋干有机层, 后 将产物溶于甲醇, 在65下回流, 薄层色谱监控反应完全, 旋干反应液得粗品, 柱层析获得 如通式I所示的第十一化合物。 8.根据权利要求6或7所述的方法, 其特征在于, 所述方法还包括: 盐的制备: 将所述第六化合物或所述第十一化合物与有机酸或无机酸混合, 制成所述 第六化合物或所述第十一化合物在药学上可接受的有机盐或无机盐; 所述无机酸包括盐酸、 硫酸、 氢溴酸、 氢碘酸和磷酸中的任意一种。
14、; 所述有机酸包括醋酸、 丙二酸、 甲磺酸、 琥珀酸、 对甲苯磺酸、 柠檬酸、 富马酸和苹果酸 中的任意一种。 9.如权利要求6或7所述的制备方法, 其特征在于, 所述取代喹诺酮指包含一个或多个 权利要求书 3/4 页 4 CN 109942654 A 4 取代基的喹诺酮; 所述取代基独立地取自一个或者多个如下取代基: 氢原子、 1-4元的烷基、 卤素取代的 1-4元烷基、 1-4元的烷氧基、 2-4元的烯基、 2-4元的炔基、 3-4元环烷基、 卤素取代的3-4元环 烷基、 羧基、 氨基甲酰基、 O-(1-4元烷基)取代的氧基甲酰基、 O-(3-4元环烷基)取代的氧基 甲酰基、 N-(1-4。
15、元烷基)取代的氨基甲酰基、 N-(3-4元环烷基)取代的氨基甲酰基、 硝基、 卤 素、 氰基、 羟基和氨基。 10.根据权利要求6或7所述的制备方法, 其特征在于, 所述取代喹诺酮具有通式所示 的结构: 通式所示结构中X包括氮原子和氧原子中的任意一种, R1、 R2分别独立地选自包括氢 原子、 1-4元烷基、 卤素取代的1-4元烷基、 2-4元烯基、 2-4元炔基、 3-4元环烷基和卤素取代 的3-4元环烷基中的任意一种。 权利要求书 4/4 页 5 CN 109942654 A 5 一种大环内酯和喹诺酮杂合物及其制备方法 技术领域 0001 本发明涉及化学合成及制药领域, 特别是涉及一种大环。
16、内酯和喹诺酮杂合物以及 一种大环内酯和喹诺酮杂合物的制备方法。 背景技术 0002 十四元大环内酯抗生素-红霉素(erythromycin)是非常重要的抗呼吸道感染的治 疗药物, 半个世纪来为人类提供了一条高效安全用药的途径, 对青霉素过敏者以及支原体 肺炎患者发挥着不可替代的作用。 目前, 临床上分离得到的呼吸道病菌菌株越来越多显示 具有耐药性, 如肺炎链球菌(S.pneumoniae)、 金黄色葡萄球菌(S.aureus)和化脓链球菌(S. pyogenes)等。 特别是目前临床上耐多药的分离菌株越来越多, 一些金黄色葡萄球菌菌株甚 至对大环内酯、 -内酰胺、 喹诺酮等多种不同抗菌机制的抗。
17、菌药物都具有耐药性。 上世纪80 年代出现的第二代红霉素-克拉霉素和阿奇霉素虽然药代动力学性质好, 但对红霉素耐药 菌并无抗菌活性。 中国已将耐药菌感染疾病列为 “重大新药创制专项” 计划的十大疾病之 一。 据估计, 全球范围内耐药性细菌引起的肺炎所造成的儿童死亡人数每年超过180万。 研 究证明红霉素与第二代红霉素的3-O-克拉定糖是诱导细菌产生耐药性的关键子结构。 因 此, 新型抗耐药菌红霉素的研发具有迫切而又重大的现实意义。 0003 与红霉素、 克拉霉素和阿奇霉素等相比, 第三代酮内酯衍生物-泰利霉素具有抗耐 药菌的活性: 3-羰基的引入避免了原先大环内酯中3-O-克拉定糖的诱导耐药性。
18、, 同时大环 上11-位新引入的芳香侧链对耐药菌产生了新的结合靶点-碱基A752, 从而获得了抗耐药菌 活性。 泰利霉素是迄今唯一美国FDA批准上市的大环内酯和喹诺酮杂合物, 但泰利霉素与少 见特异体质相关但易致死的肝毒性使得FDA限制其适用症, 撤销了两个关于鼻窦炎、 支气管 炎适应症和皮肤感染适应症, 仅剩下社区获得性细菌性肺炎适应症。 进一步研究显示泰利 霉素的侧链结构末端芳基即 “吡啶基咪唑” 与 “烟碱” (1-甲基-2-(3-吡啶基)吡咯烷)结构类 似, 而且侧链咪唑代谢不稳定而降解后所引起的脱靶效应(作用于烟碱胆碱受体) 与各种 毒副作用高度相关。 0004 此 前 , 我 们 。
19、开 发 了 不 同 于 泰 利 霉 素 结 构 的 新 型 9 - 肟 酮 内 酯 衍 生 物 (201010110079.5; 201010171484.8), 其9-位烯丙基和炔丙基末端引入的喹啉基和异喹啉 基大大提高了抗耐药菌活性。 后来我们在此基础上又优化了芳基, 开发了新型9-肟酮内酯 衍生物(201710025471.1)。 其芳基被氨基或者氨基甲酰基取代, 这些9-肟酮内酯对于诱导 耐药(i-erm)或者外排耐药(mef)的病原菌具有较好的抗菌活性, 但是对于组成型erm肺炎 链球菌等的最低抑菌浓度迄今均不低于32 g/mL。 组成型erm菌其耐药基因的表达不依赖与 红霉素药物的。
20、诱导, 通常耐药水平MIC值很高, 远高于诱导erm和外排耐药菌。 社区获得性细 菌性肺炎的主要病原菌包括肺炎链球菌、 嗜血流感杆菌和卡他莫拉菌, 此外金黄色葡萄球 菌也是病原菌之一。 其中组成型肺炎链球菌(c-erm)是目前临床上常见的导致细菌性肺炎 感染的高水平耐药病原菌。 因此, 需要寻找新的结构, 既不同于具有肝毒性的泰利霉素, 同 时又克服目前9-肟酮内酯对组成型肺炎链球菌活性很低的缺陷, 同时对嗜血流感、 金黄色 说明书 1/31 页 6 CN 109942654 A 6 葡萄球菌等也有抗菌活性, 以用于临床上含有肺炎链球菌在内的病原微生物引起的肺炎。 0005 总之, 需要本领域。
21、技术人员迫切解决的一个技术问题就是: 如何能够提供一种红 霉素衍生物即一种大环内酯的衍生物, 既能够较好的适应工业化生产, 并且针对临床上常 见的红霉素耐药的肺炎链球菌、 金黄色葡萄球菌、 化脓链球菌、 卡他莫拉和嗜血流感菌等致 病菌具有与上市酮内酯一泰利霉素相当或者更高的抗敏感菌和抗耐药菌活性, 治疗临床细 菌性肺炎或者其他微生物(如支原体、 军团菌属等)引起的肺炎、 以及其他组织感染。 发明内容 0006 为了解决上述问题, 本发明公开了一种大环内酯和喹诺酮杂合物, 所述大环内酯 和喹诺酮杂合物为具有通式I和通式II的化合物, 或者, 所述大环内酯和喹诺酮杂合物包括 具有所述通式I和通式I。
22、I的化合物与无机酸或有机酸形成的药学可接受的盐; 0007 0008 其中, 所述通式I和通式II中, Ar包括取代喹诺酮。 0009 所述取代喹诺酮指包含一个或多个独立取代基的喹诺酮。 0010 所述取代基独立地取自一个或者多个如下取代基: 氢原子、 1-4元的烷基、 卤素取 代的1-4元烷基、 1-4元的烷氧基、 2-4元的烯基、 2-4元的炔基、 3-4元环烷基、 卤素取代的3-4 元环烷基、 羧基、 氨基甲酰基、 O- (1-4元烷基)取代的氧基甲酰基、 O-(3-4元环烷基)取代的 氧基甲酰基、 N-(1-4元烷基)取代的氨基甲酰基、 N-(3-4元环烷基)取代的氨基甲酰基、 硝 基。
23、、 卤素、 氰基、 羟基和氨基。 0011 本发明实施例还提供了一种大环内酯和喹诺酮杂合物的制备方法, 所述方法包 括: 0012 第二化合物的制备: 将第一化合物溶解在二氯甲烷中, 滴加乙酸酐反应, 反应过程 中使用薄层色谱监控, 反应完全结束后, 使用饱和NaHCO3溶液洗5次, 再用饱和NaCl溶液洗1 次, 旋干, 起泡后在真空烘箱中干燥, 得到第二化合物。 0013 第三化合物的制备: 将所述第二化合物溶于四氢呋喃, 再加入二甲亚砜, 在氩气保 护下添加叔丁醇钾, 在室温下反应, 薄层色谱监控所述第二化合物9位乙酰基全部脱去后补 加叔丁醇钾, 在氩气保护下滴加80炔丙基溴, 反应30。
24、-45分钟, 薄层色谱监控反应进程, 反 应结束后, 加入乙酸乙酯与蒸馏水, 使用乙酸乙酯萃取水相三次, 合并有机相, 使用饱和 NaCl溶液洗涤有机相, 旋干, 起泡后在真空烘箱中干燥, 得到第一中间产物。 0014 将所述第一中间产物溶于二氯甲烷, 在氩气保护、 -10的环境下, 滴加吡啶, 再滴 说明书 2/31 页 7 CN 109942654 A 7 加三光气的二氯甲烷溶液, 保持温度不变反应, 再转移至常温下反应至反应结束, 冰浴下滴 加饱和NaCl溶液, 常温搅拌, 用蒸馏水、 饱和NaHCO3, 饱和NaCl溶液依次洗涤有机相, 分液获 得有机相, 旋干, 柱层析获得第三化合物。
25、。 0015 第四化合物的制备: 将N-氯代丁二酰亚胺溶于二氯甲烷, 在-15下搅拌, 逐滴加 入二甲硫醚, 产生白色絮状沉淀, 将所述第三化合物溶于二氯甲烷缓慢滴加到N-氯代丁二 酰亚胺的二氯甲烷溶液中, 在-10下, 搅拌反应至薄层色谱监控所述第四化合物转化率在 95以上, 将温度调至-5, 滴加三乙胺, 反应完全结束后, 依次用蒸馏水、 饱和NaHCO3溶 液、 饱和NaCl溶液洗涤有机相, 分液获得有机相, 旋干, 获得第四化合物。 0016 第五化合物的制备: 在0下将所述第四化合物溶于N, N-二甲基甲酰胺, 待温度稳 定后, 在氩气保护下加入60的NaH反应, 再将反应转移至-5。
26、冰盐浴, 加入N-氟代双苯磺 酰胺搅拌, 薄层色谱监控反应完全结束后, 依次用NaOH溶液、 饱和NaHCO3, 饱和NaCl溶液洗 涤有机相, 分液获得有机相, 旋干, 柱层析后获得第五化合物。 0017 第六化合物的制备: 将碘化亚铜、 三乙胺、 取代喹诺酮溶于乙腈, 置于压力瓶中常 温搅拌, 加入所述第五化合物、 双(三苯基磷)二氯化钯用氩气置换8次, 密封, 于60搅拌反 应至反应完全, 反应完成后加入乙酸乙酯, 再用蒸馏水水洗3次, 饱和氯化钠溶液洗1次, 分 液获得有机相, 旋干, 获得第二中间产物, 将所述第二中间产物溶于甲醇, 在 65下回流, 薄层色谱监控反应完全结束后旋干反。
27、应液获得粗品, 柱层析后获得如通式II所示的第六化 合物。 0018 与现有技术相比, 本发明包括以下优点: 0019 本发明实施例提供了一种新型的由大环内酯和喹诺酮(或喹诺酮类似物)两种子 结构组成的杂合物, 其针对临床上常见的耐药肺炎链球菌、 金黄色葡萄球菌、 化脓链球菌、 卡他莫拉和嗜血流感菌等致病菌具有与上市酮内酯-泰利霉素相当或者更高的抗敏感菌和 抗耐药菌活性, 治疗临床细菌性肺炎或者其他微生物(如支原体、 军团菌属等)引起的肺炎、 以及其他组织感染, 本发明实施例还提供了一种新型的由大环内酯和喹诺酮(或喹诺酮类 似物)两种子结构组成的杂合物的制备方法, 能够较好的适应工作化生产。 。
28、附图说明 0020 图1是本发明实施例中一种大环内酯和喹诺酮杂合物的制备方法流程图; 0021 图2是本发明实施例中一种大环内酯和喹诺酮杂合物的另一种制备方法流程图。 具体实施方式 0022 为使本发明的上述目的、 特征和优点能够更加明显易懂, 下面结合附图和具体实 施方式对本发明作进一步详细的说明。 0023 实施例一 0024 本发明提供了一种大环内酯和喹诺酮杂合物, 所述大环内酯和喹诺酮杂合物为具 有通式I和通式II的化合物, 或者, 所述大环内酯和喹诺酮杂合物包括具有所述通式I和通 式II的化合物与无机酸或有机酸形成的药学可接受的盐, 该盐作为前药(prodrug)在体内 生理条件下代。
29、谢或转化成通式结构所示化合物, 并作为活性成分起着药理作用。 本发明实 施例中, 各种药用可接受的酸可以在通式I和通式II中5-O-德糖胺二甲氨基的氮上形成盐, 说明书 3/31 页 8 CN 109942654 A 8 前药在2 -OH上酯化, 类似的如红霉素的琥珀酸乙酯作为前药, 经过体内水解酯基可再次释 放出2 -OH。 前药的制备常规方法见 Design of Prodrugs (H.Bundgaad, Elsevier, 1985)。 0025 0026 其中, 所述通式I和通式II中, Ar包括取代喹诺酮。 0027 所述取代喹诺酮指包含一个或多个独立取代基的喹诺酮。 0028 所。
30、述取代基独立地取自一个或者多个如下取代基: 氢原子、 1-4元的烷基、 卤素取 代的1-4元烷基、 1-4元的烷氧基、 2-4元的烯基、 2-4元的炔基、 3-4元环烷基、 卤素取代的3-4 元环烷基、 羧基、 氨基甲酰基、 O- (1-4元烷基)取代的氧基甲酰基、 O-(3-4元环烷基)取代的 氧基甲酰基、 N-(1-4元烷基)取代的氨基甲酰基、 N-(3-4元环烷基)取代的氨基甲酰基、 硝 基、 卤素、 氰基、 羟基和氨基。 0029 本发明实施例中所用的术语 “喹诺酮” 表示如下所示结构: 0030 0031 本发明实施例中使用的术语 “a-b元烷基” (a, b为数字)是指饱和的直链或。
31、支链烃 基, 具有a-b个碳原子, 例如1-6元烷基, 1-4元烷基。 优选的1-6元烷基为甲基、 乙基、 正丙基、 异丙基、 仲丁基、 叔丁基、 叔戊基或新戊基。 优选的1-4元烷基为甲基、 乙基、 正丙基、 异丙基、 正丁基、 异丁基或叔丁基, 进一步优选为甲基、 乙基、 正丙基或异丙基。 上述多种烷基仅用于 举例, 其他未列举出的烷基也具有相似的性能, 此处基于篇幅限制不做赘述。 0032 本发明实施例中使用的术语 “a-b元烷氧基” (a, b为数字)是指含有氧原子的饱和 直链或支链烃基, 具有a-b个碳原子, 优选为甲氧基、 乙氧基或异丙氧基。 上述多种烷氧基仅 用于举例, 其他未列。
32、举出的烷氧基也具有相似的性能, 此处基于篇幅限制不做赘述。 0033 本发明实施例中使用的术语 “a-b元环烷基” 意指具有a-b个碳原子的饱和环状烃 基, 或者含有烷基取代的环状烃基。 优选的环烷基为环丙基、 环丙基甲基、 环丁基、 环戊基或 环己基, 进一步优选为环丙基、 环丙基甲基或环丁基。 0034 本发明实施例中使用的术语 “a-b元烯基” 是指含有至少一个碳碳双键(-CC-)的 烯属不饱和直链或支链烃基, 具有a-b个碳原子。 优选的烯基为乙烯基, 丙烯基。 0035 本发明实施例中使用的术语 “a-b元炔基” 是指含有至少一个碳碳三键(-CC-)的 炔属不饱和直链或支链烃基, 具。
33、有a-b个碳原子。 优选的炔基为乙炔基或丙炔基。 上述多种 说明书 4/31 页 9 CN 109942654 A 9 烯基和炔基仅用于举例, 其他未列举出的烯基和炔基也具有相似的性能, 此处基于篇幅限 制不做赘述。 0036 本发明实施例中所用的术语 “卤素” 意指氟、 氯、 溴或碘。 优选的卤素为氟和氯。 0037 本发明实施例中所用的术语 “取代” 是指化合物或者基团被一个或两个或更多个 独立选自下列的取代基取代: a-b元烷基、 卤素取代的a-b元烷基、 a-b元杂烷基、 a-b元环烷 基、 卤素取代的a-b元环烷基、 a-b元杂环烷基、 a-b元烷氧基、 芳基、 杂芳基、 a-b元烯。
34、基、 a-b 元炔基、 硝基、 卤素、 氰基、 羟基、 氨基等。 本申请中优选为氢原子、 1-4元的烷基、 卤素取代的 1-4元烷基、 1-4元的烷氧基、 2-4元的烯基、 2-4元的炔基、 3-4 元环烷基、 卤素取代的3-4元 环烷基、 羧基、 氨基甲酰基、 O-(1-4元烷基)取代的氧基甲酰基、 O-(3-4元环烷基)取代的氧 基甲酰基、 N-(1-4 元烷基)取代的氨基甲酰基、 N-(3-4元环烷基)取代的氨基甲酰基、 硝基、 卤素、 氰基、 羟基和氨基。 优选的取代基数目为1-2个。 0038 优选地, 取代喹诺酮的取代位置可以是1-位、 3-位、 5-位、 7-位、 8位。 优选地。
35、, 所述 取代喹诺酮具有通式III所示的结构; 0039 0040 通式III所示结构中X包括氮原子和氧原子中的任意一种, R1、 R2分别独立地选自包 括氢原子、 1-4元烷基、 卤素取代的1-4元烷基、 2-4元烯基、 2-4元炔基和3-4元环烷基中的任 意一种。 0041 优选地, 所述R1、 R2分别独立取自氢原子、 甲基、 三氟甲基、 乙基、 2-氟乙基、 2, 2-二 氟乙基、 2, 2, 2-三氟乙基、 异丙基、 环丙基、 环丙基甲基、 2-氟环丙基、 2-丙烯基、 2-丙炔基、 正丁基、 异丁基、 叔丁基和环丁基中的任意一种。 0042 优选地, 所述Ar包括如下所示的结构: 。
36、说明书 5/31 页 10 CN 109942654 A 10 0043 0044 优选地, 所述无机酸包括盐酸、 硫酸、 氢溴酸、 氢碘酸和磷酸中的任意一种。 0045 优选地, 所述有机酸包括醋酸、 丙二酸、 甲磺酸、 琥珀酸、 对甲苯磺酸、 柠檬酸、 富马 酸和苹果酸中的任意一种。 0046 上述多种取代化合物仅用于举例, 在同一分类中, 其他未列举出的取代化合物也 具有相似的性能, 此处基于篇幅限制不做赘述。 0047 本发明还提供一种大环内酯和喹诺酮杂合物的制备方法, 具体地, 图1是本发明实 施例中一种大环内酯和喹诺酮杂合物的制备方法流程图, 参照图1, 制备所述通式I和通式 II。
37、的化合物的方法可以包括: 0048 第二化合物的制备: 将第一化合物溶解在二氯甲烷中, 滴加乙酸酐反应, 反应过程 中使用薄层色谱监控, 反应完全结束后, 使用饱和NaHCO3溶液洗5次, 再用饱和NaCl溶液洗1 次, 旋干, 起泡后在真空烘箱中干燥, 得到第二化合物。 0049 本发明实施例中, 所述第一化合物的结构如下所示: 0050 0051 所述第一化合物可参考European Journal of Medicinal Chemistry 45 (2010) 3627-3635进行制备获得, 本领域技术人员也可根据实际情况选择获得第一化合物的方法, 本发明对此不做具体限制。 0052。
38、 第三化合物的制备: 将所述第二化合物溶于四氢呋喃, 再加入二甲亚砜, 在氩气保 护下添加叔丁醇钾, 在室温下反应, 薄层色谱监控所述第二化合物9位乙酰基全部脱去后补 加叔丁醇钾, 在氩气保护下滴加80炔丙基溴, 反应30-45分钟, 薄层色谱监控反应进程, 反 说明书 6/31 页 11 CN 109942654 A 11 应结束后, 加入乙酸乙酯与蒸馏水, 使用乙酸乙酯萃取水相三次, 合并有机相, 使用饱和 NaCl溶液洗涤有机相, 旋干, 起泡后在真空烘箱中干燥, 得到第一中间产物。 0053 将所述第一中间产物溶于二氯甲烷, 在氩气保护、 -10的环境下, 滴加吡啶, 再滴 加三光气的。
39、二氯甲烷溶液, 保持温度不变反应, 再转移至常温下反应至反应结束, 冰浴下滴 加饱和NaCl溶液, 常温搅拌, 用蒸馏水、 饱和NaHCO3, 饱和NaCl溶液依次洗涤有机相, 分液获 得有机相, 旋干, 柱层析获得第三化合物。 0054 第四化合物的制备: 将N-氯代丁二酰亚胺溶于二氯甲烷, 在-15下搅拌, 逐滴加 入二甲硫醚, 产生白色絮状沉淀, 将所述第三化合物溶于二氯甲烷缓慢滴加到N-氯代丁二 酰亚胺的二氯甲烷溶液中, 在-10下, 搅拌反应至薄层色谱监控所述第四化合物转化率在 95以上, 将温度调至-5, 滴加三乙胺, 反应完全结束后, 依次用蒸馏水、 饱和NaHCO3溶液、 饱和。
40、NaCl溶液洗涤有机相, 分液获得有机相, 旋干, 获得第四化合物。 0055 第五化合物的制备: 在0下将所述第四化合物溶于N, N-二甲基甲酰胺, 待温度稳 定后, 在氩气保护下加入60的NaH反应, 再将反应转移至-5冰盐浴, 加入N-氟代双苯磺 酰胺搅拌, 薄层色谱监控反应完全结束后, 依次用NaOH溶液、 饱和NaHCO3, 饱和NaCl溶液洗 涤有机相, 分液获得有机相, 旋干, 柱层析后获得第五化合物。 0056 第六化合物的制备: 将碘化亚铜、 三乙胺、 取代喹诺酮的卤代物溶于乙腈, 置于压 力瓶中常温搅拌, 加入所述第五化合物、 双(三苯基磷) 二氯化钯用氩气置换8次, 密封。
41、, 于 60搅拌反应至反应完全, 反应完成后加入乙酸乙酯, 再用蒸馏水水洗3次, 饱和氯化钠溶 液洗1次, 分液获得有机相, 旋干, 获得第二中间产物, 将所述第二中间产物溶于甲醇, 在65 下回流, 薄层色谱监控反应完全结束后旋干反应液获得粗品, 柱层析后获得如通式II所 示的第六化合物。 0057 本发明实施例中, 通过在反应物中使用取代喹诺酮的卤代物, 以获得大环内酯和 喹诺酮杂合物, 其中期待喹诺酮的卤代物中的卤素优选地可以是溴和碘。 0058 图2是本发明实施例中一种大环内酯和喹诺酮杂合物的另一种制备方法流程图, 如图2所示, 所述方法还包括: 0059 第二化合物的制备: 将第一化。
42、合物溶解在二氯甲烷中, 滴加乙酸酐反应, 反应过程 中使用薄层色谱监控, 反应完全结束后, 使用饱和NaHCO3溶液洗5次, 再用饱和NaCl溶液洗1 次, 旋干, 起泡后在真空烘箱中干燥, 得到第二化合物。 0060 第七化合物的制备: 将所述第二化合物溶于四氢呋喃, 再加入二甲亚砜, 在氩气保 护下加入叔丁醇钾, 室温下反应至薄层色谱监控所述第二化合物的9位乙酰基全部脱去, 补 加叔丁醇钾, 氩气保护下加入烯丙基溴, 反应30-40分钟, 薄层色谱监控反应完全后, 加入二 氯甲烷与蒸馏水, 分液后用二氯甲烷三次萃取水相, 合并有机相, 用饱和NaCl溶液洗涤有机 相, 旋干起泡, 烘干, 。
43、得到所述第七化合物。 0061 第八化合物的制备: 将所述第七化合物溶于二氯甲烷, 在氩气保护、 -10下滴加 吡啶, 再滴加三光气的二氯甲烷溶液, 保持-10反应4小时, 再移至常温反应18小时后进行 后处理, 后处理时在冰浴下滴加饱和 NaCl溶液, 常温搅拌, 后用蒸馏水、 饱和NaHCO3, 饱和 NaCl溶液洗涤有机相, 分液, 旋干, 柱层析获得所述第八化合物。 0062 第九化合物的制备: 将N-氯代丁二酰亚胺溶于二氯甲烷, 在-15下搅拌, 逐滴加 入二甲硫醚, 产生白色絮状沉淀, 将所述第八化合物的二氯甲烷溶液缓慢滴加到N-氯代丁 说明书 7/31 页 12 CN 10994。
44、2654 A 12 二酰亚胺的二氯甲烷溶液中, 在-10下, 搅拌反应至薄层色谱监控所述第八化合物转化率 在95以上, 将温度调至-5, 滴加三乙胺, 反应完全结束后, 依次用蒸馏水、 饱和NaHCO3溶 液、 饱和NaCl溶液洗涤有机相, 分液获得有机相, 旋干, 获得所述第九化合物。 0063 第十化合物的制备: 在0下将所述第九化合物溶于N, N-二甲基甲酰胺, 待温度稳 定后, 在氩气保护下加入60NaH反应, 后将反应转移至-5冰盐浴中, 加入N-氟代双苯磺 酰胺保持温度, 搅拌, 薄层色谱监控反应完全后, 依次加入NaOH溶液, 饱和NaHCO3, 饱和NaCl 溶液洗涤有机相, 。
45、分液, 旋干, 柱层析获得所述第十化合物。 0064 第十一化合物的制备: 将所述第十化合物、 醋酸钯、 三(邻甲基苯基) 磷、 取代喹诺 酮的卤代物、 三乙胺溶于乙腈, 置于压力瓶中, 氩气置换8 次, 密封后在60下反应, 后升温 至90搅拌, 反应完全后加入乙酸乙酯, 水洗3次, 饱和氯化钠溶液洗1次, 分液后旋干有机 层, 后将产物溶于甲醇, 在65下回流, 薄层色谱监控反应完全, 旋干反应液得粗品, 柱层析 获得如通式I所示的第十一化合物。 0065 可选地, 所述方法还包括: 0066 盐的制备: 将所述第六化合物或所述第十一化合物与有机酸或无机酸混合, 制成 所述第六化合物或所述。
46、第十一化合物在药学上可接受的有机盐或无机盐。 0067 优选地, 所述无机酸包括盐酸、 硫酸、 氢溴酸、 氢碘酸和磷酸中的任意一种; 0068 优选地, 所述有机酸包括醋酸、 丙二酸、 甲磺酸、 琥珀酸、 对甲苯磺酸、 柠檬酸、 富马 酸和苹果酸中的任意一种。 0069 可选地, 所述取代喹诺酮指包含一个或多个取代基的喹诺酮。 0070 可选地, 所述取代基独立地取自一个或者多个如下取代基: 氢原子、 1-4元的烷 基、 卤素取代的1-4元烷基、 1-4元的烷氧基、 2-4元的烯基、 2-4元的炔基、 3-4元环烷基、 卤 素取代的3-4元环烷基、 羧基、 氨基甲酰基、 O-(1-4元烷基)取。
47、代的氧基甲酰基、 O-(3-4元环 烷基)取代的氧基甲酰基、 N-(1-4元烷基)取代的氨基甲酰基、 N-(3-4元环烷基) 取代的氨 基甲酰基、 硝基、 卤素、 氰基、 羟基和氨基。 0071 可选地, 所述取代喹诺酮具有通式III所示的结构: 0072 0073 通式III所示结构中X包括氮原子和氧原子中的任意一种, R1、 R2分别独立地选自包 括氢原子、 1-4元烷基、 卤素取代的1-4元烷基、 2-4元烯基、 2-4元炔基、 3-4元环烷基和卤素 取代的3-4元环烷基中的任意一种。 0074 本发明实施例中, 针对不同衍生物的结构需求, 可以使用不同的卤代化合物进行 反应, 通过获得。
48、不同的Ar基团, 合成不同的大环内酯和喹诺酮杂合物, Ar基团可以包括如下 所示结构的基团: 说明书 8/31 页 13 CN 109942654 A 13 0075 0076 其中, a是喹诺酮, b-t是取代喹诺酮, 以上结构仅用于举例说明, 在其分类中其他 类似的结构也可作为大环内酯和喹诺酮杂合物的Ar基团, 本发明对此不做限制。 其中, 取代 喹诺酮的卤代物的卤素取代位置, 包括Ar基团与母核结构连接键所处的位置。 0077 可选地, 所述取代喹诺酮指包含一个或多个取代基的喹诺酮。 0078 所述取代基独立地取自一个或者多个如下取代基: 氢原子、 1-4元的烷基、 卤素取 代的1-4元。
49、烷基、 1-4元的烷氧基、 2-4元的烯基、 2-4元的炔基、 3-4元环烷基、 卤素取代的3-4 元环烷基、 羧基、 氨基甲酰基、 O- (1-4元烷基)取代的氧基甲酰基、 O-(3-4元环烷基)取代的 氧基甲酰基、 N-(1-4元烷基)取代的氨基甲酰基、 N-(3-4元环烷基)取代的氨基甲酰基、 硝 基、 卤素、 氰基、 羟基和氨基。 0079 本发明实施例提供了一种大环内酯和喹诺酮杂合物, 既能够较好的适应工业化生 产, 并且针对临床上常见的红霉素耐药的肺炎链球菌、 金黄色葡萄球菌、 化脓链球菌、 卡他 莫拉和嗜血流感菌等致病菌具有良好的抗敏感菌和抗耐药菌活性, 能有效治疗临床细菌性 肺。
50、炎或者其他微生物(如支原体、 军团菌属等)引起的肺炎、 以及其他组织感染。 0080 实施例二 0081 本发明实施例中一种大环内酯和喹诺酮杂合物的反应路线如下所示, 所述大环内 酯和喹诺酮杂合物为具有通式II的化合物, 制备如通式II所示的所述大环内酯和喹诺酮杂 合物的方法具体可以包括以下步骤: 说明书 9/31 页 14 CN 109942654 A 14 0082 0083 反应条件为: (a)乙酸酐, 二氯甲烷; (b)叔丁醇钾, 80炔丙基溴, 二甲基亚砜/四 氢呋喃(1 1); (c)吡啶, 三光气, 二氯甲烷, -10-室温; (d) N-氯代琥珀酰亚胺(NCS), 二甲 硫醚(。
- 内容关键字: 内酯 喹诺酮杂合物 及其 制备 方法
 养殖禽畜排泄物固液分离处理设备.pdf
养殖禽畜排泄物固液分离处理设备.pdf
 铝合金平板加工用夹具.pdf
铝合金平板加工用夹具.pdf
 抗弯抗拉低频闪灯带.pdf
抗弯抗拉低频闪灯带.pdf
 图书馆空气调节装置.pdf
图书馆空气调节装置.pdf
 路面高差检测装置.pdf
路面高差检测装置.pdf
 U肋板转运机器人的行走机构切换装置.pdf
U肋板转运机器人的行走机构切换装置.pdf
 冲压机用的精准送料装置.pdf
冲压机用的精准送料装置.pdf
 茶叶加工用萎凋装置.pdf
茶叶加工用萎凋装置.pdf
 糠醛残液回收釜.pdf
糠醛残液回收釜.pdf
 蓄电池组中实时时钟芯片供电电路.pdf
蓄电池组中实时时钟芯片供电电路.pdf
 水平防跷板调节压轮机构.pdf
水平防跷板调节压轮机构.pdf
 高压线圈引出装置.pdf
高压线圈引出装置.pdf
 热管节能型离子溶液碳捕集装置.pdf
热管节能型离子溶液碳捕集装置.pdf
 工作效率高的多单元碟状容器定量充填装置.pdf
工作效率高的多单元碟状容器定量充填装置.pdf
 用于散热器铜管的收卷辅助设备.pdf
用于散热器铜管的收卷辅助设备.pdf
 手提式电动冷烟雾机的驱动式收置结构.pdf
手提式电动冷烟雾机的驱动式收置结构.pdf
 气相三氧化硫磺化反应系统.pdf
气相三氧化硫磺化反应系统.pdf
 基于多频点扫频工作的超声波控藻系统.pdf
基于多频点扫频工作的超声波控藻系统.pdf
 改进型太阳能板旋转支架.pdf
改进型太阳能板旋转支架.pdf
 基于实时网络的风电场智能图像监控系统.pdf
基于实时网络的风电场智能图像监控系统.pdf
 自动驾驶路线规划方法和系统.pdf
自动驾驶路线规划方法和系统.pdf
 高可靠性的平板探测器数据采集方法、系统及计算机.pdf
高可靠性的平板探测器数据采集方法、系统及计算机.pdf
 多区域虚拟电厂协同优化运行方法.pdf
多区域虚拟电厂协同优化运行方法.pdf
 基于深度学习眼球追踪光斑检测方法及装置.pdf
基于深度学习眼球追踪光斑检测方法及装置.pdf
 风电电能质量评估方法及装置.pdf
风电电能质量评估方法及装置.pdf
 TBC太阳能电池的制备方法、TBC太阳能电池与光伏系统.pdf
TBC太阳能电池的制备方法、TBC太阳能电池与光伏系统.pdf
 森林冠层高度与地理环境协变量关系确定方法及系统.pdf
森林冠层高度与地理环境协变量关系确定方法及系统.pdf
 基于眼动数据的自动冻屏方法、装置、设备及存储介质.pdf
基于眼动数据的自动冻屏方法、装置、设备及存储介质.pdf
 U形肋焊接定位系统.pdf
U形肋焊接定位系统.pdf
 太阳能组件撕胶引线点胶一体机及生产方法.pdf
太阳能组件撕胶引线点胶一体机及生产方法.pdf
 基于辐射传输参数应用卷积神经网络的水深地图反演方法.pdf
基于辐射传输参数应用卷积神经网络的水深地图反演方法.pdf
 化工区域的空气污染溯源方法及装置.pdf
化工区域的空气污染溯源方法及装置.pdf
 品种定位器.pdf
品种定位器.pdf
 一种快速高效的大闸蟹清洗装置.pdf
一种快速高效的大闸蟹清洗装置.pdf
 用于降低血脂的药物组合物.pdf
用于降低血脂的药物组合物.pdf
 钟花报春花总黄酮的用途.pdf
钟花报春花总黄酮的用途.pdf
 防调节阀脱落的氧气袋.pdf
防调节阀脱落的氧气袋.pdf
 一种冷冻式的鱼肉分离机.pdf
一种冷冻式的鱼肉分离机.pdf
 一种家用小型肉类拌馅用拌馅机.pdf
一种家用小型肉类拌馅用拌馅机.pdf
 包括罗格列酮和另一种抗糖尿病药的新组合物.pdf
包括罗格列酮和另一种抗糖尿病药的新组合物.pdf
 一种简易胃部负压引流袋.pdf
一种简易胃部负压引流袋.pdf
 一种基于履带底盘的遥控果蔬喷药机.pdf
一种基于履带底盘的遥控果蔬喷药机.pdf
 一种易操作的电动修枝剪.pdf
一种易操作的电动修枝剪.pdf
 一种具有标识功能的导引导丝.pdf
一种具有标识功能的导引导丝.pdf
 一种林地捲棒栽培猪苓的方法.pdf
一种林地捲棒栽培猪苓的方法.pdf
 一种埋藏式自动灌溉系统.pdf
一种埋藏式自动灌溉系统.pdf
 一种工业化自动净水养殖池.pdf
一种工业化自动净水养殖池.pdf
 一种水稻插秧机施肥器用可调节拨料槽.pdf
一种水稻插秧机施肥器用可调节拨料槽.pdf
 治疗滴虫性阴道炎的中药组合物及组合物纳丸的制备方法.pdf
治疗滴虫性阴道炎的中药组合物及组合物纳丸的制备方法.pdf
 智能土豆播种机.pdf
智能土豆播种机.pdf
 具有提醒功能的智能吸收垫.pdf
具有提醒功能的智能吸收垫.pdf
相关文档
更多 新型磁翻板液位计.pdf
新型磁翻板液位计.pdf
 低热值气体燃烧检测装置.pdf
低热值气体燃烧检测装置.pdf
 链轮与齿轮相结合的齿轮箱.pdf
链轮与齿轮相结合的齿轮箱.pdf
 PIN器件及其制作方法、感光组件、显示装置.pdf
PIN器件及其制作方法、感光组件、显示装置.pdf
 双孢蘑菇分级系统.pdf
双孢蘑菇分级系统.pdf
 3D水转印精准上色工艺.pdf
3D水转印精准上色工艺.pdf
 可实现三级压力控制的液压夹具.pdf
可实现三级压力控制的液压夹具.pdf
 具有干燥预热性能的热风炉.pdf
具有干燥预热性能的热风炉.pdf
 基于电子围栏的车辆监控系统及其监控方法.pdf
基于电子围栏的车辆监控系统及其监控方法.pdf
 测绘棱镜用的手持可升降支架装置.pdf
测绘棱镜用的手持可升降支架装置.pdf
 新型超高频读写模块.pdf
新型超高频读写模块.pdf
 冷却散热型减速机及其防撞外壳.pdf
冷却散热型减速机及其防撞外壳.pdf
 具有金属质感的双组份聚氨酯胶粘剂及其制备方法和在环保透水路面中的应用.pdf
具有金属质感的双组份聚氨酯胶粘剂及其制备方法和在环保透水路面中的应用.pdf
 锅炉用堆焊合金材料.pdf
锅炉用堆焊合金材料.pdf
 空调器及其控制方法.pdf
空调器及其控制方法.pdf
 集成式直流风力发电机底座.pdf
集成式直流风力发电机底座.pdf
 具有多自由度的注塑模具.pdf
具有多自由度的注塑模具.pdf
 服务器及风墙.pdf
服务器及风墙.pdf
 基于集成核独立成分分析模型的过程监测方法.pdf
基于集成核独立成分分析模型的过程监测方法.pdf
 单窗口双通道红外探测器及方法.pdf
单窗口双通道红外探测器及方法.pdf